ปัจจุบันประเทศไทยกำลังเปลี่ยนเข้าสู่สังคมผู้สูงวัย (aging society) ทำให้โครงสร้างของประชากรมีการเพิ่มขึ้นของประชากรในวัยเกิน 60 ปี และ การลดลงของประชากรในวัยทำงาน ส่งผลให้เกิดประเด็นที่ท้าทายต่อการพัฒนาประเทศและความกินดีอยู่ดีของประชากรโดยรวม หนึ่งในแนวทางการสร้างสังคมผู้สูงอายุที่เข้มแข็งคือการส่งเสริมให้ผู้สูงอายุเข้าถึงการบริการสุขภาพอย่างทั่วถึง รวมถึงความสามารถที่จะตรวจสุขภาพเบื้องต้นได้ด้วยตัวเอง อุปกรณ์ตรวจวัด ณ จุดดูแลผู้ป่วย (point of care) สำหรับการตรวจวินิจฉัยเบื้องต้น (early diagnosis) จึงมีความสำคัญ ถึงแม้การตรวจวัดเบื้องต้นเหล่านี้จะไม่อาจทดแทนการตรวจวินิจฉัยโดยแพทย์ผู้ชำนาญการในโรงพยาบาล การมีอุปกรณ์ดังกล่าวจะช่วยแจ้งเตือนให้ผู้ที่มีความเสี่ยงต่อโรคเพิ่มความระมัดระวัง ไม่ทำกิจกรรมที่เพิ่มความเสี่ยง และรีบเข้ารับการตรวจวินิจฉัยอย่างละเอียดโดยแพทย์ผู้ชำนาญต่อไป
แนวทางหนึ่งในการพัฒนาอุปกรณ์ตรวจวัดดังกล่าวคือการใช้ไบโอเซนเซอร์และเคมิคัลเซนเซอร์ที่สามารถตรวจวัดปริมาณของสารเป้าหมายที่สนใจได้อย่างแม่นยำ ไบโอเซนเซอร์ประกอบด้วยส่วนจดจำทางชีวภาพ (biorecognition elements) ที่จับกับสารที่ต้องการตรวจวัดอย่างจำเพาะเจาะจง และทรานสดิวเซอร์ (transducer) ที่ทำหน้าที่แปลงอันตรกิริยาที่เกิดขึ้นให้เป็นสัญญาณที่สามารถวัดได้ ทั้งนี้ อาจแบ่งไบโอเซนเซอร์ตามลักษณะของทรานสดิวเซอร์ เช่น ไบโอเซนเซอร์เชิงเคมีไฟฟ้า ไบโอเซนเซอร์เชิงแสง เป็นต้น ส่วนเคมิคัลเซนเซอร์มีความแตกต่างกับไบโอเซนเซอร์เล็กน้อยในลักษณะที่ส่วนที่ทำอันตรกิริยากับสารที่ต้องการตรวจวัดเป็นสารเคมี ข้อดีของไบโอเซนเซอร์และเคมิคัลเซนเซอร์เมื่อเทียบกับเทคนิคการวิเคราะห์เชิงปริมาณในห้องปฏิบัติการคือ มีความจำเพาะเจาะจงและความไววิเคราะห์สูง ขีดจำกัดของการตรวจวัดต่ำ ใช้งานง่าย และ มักจะใช้เวลาในการตรวจวัดน้อย ดังนั้น ไบโอเซนเซอร์และเคมิคัลเซนเซอร์จึงเป็นอุปกรณ์ที่ช่วยเพิ่มโอกาสในการเฝ้าระวังปัญหาสุขภาพในสังคมผู้สูงอายุได้ โครงการวิจัยนี้มีเป้าหมายที่จะพัฒนาไบโอเซนเซอร์และเคมิคัลเซนเซอร์ที่สามารถตรวจวัดสารบ่งชี้ปัญหาสุขภาพในผู้สูงอายุแบบตรวจวัดในปัสสาวะ โดยเน้นการตรวจวัดสารบ่งชี้โรคไต ได้แก่ ไมโครอัลบูมิน ครีเอทินิน และ โพแทสเซียมไอออน
ไบโอเซนเซอร์สำหรับตรวจวัดไมโครอัลบูมิน
ไมโครอัลบูมิน (microalbumin) คือโปรตีน human serum albumin (HSA) ที่ถูกขับออกมาพร้อมกับปัสสาวะ ในคนปกติมีการรายงานว่าระดับของไมโครอัลบูมินในปัสสาวะมีค่าไม่เกิน 373 นาโนโมลาร์ [1] แต่ในผู้ที่ไตสูญเสียความสามารถในการกรองปริมาณไมโครอัลบูมินจะเพิ่มสูงขึ้นเกินค่าดังกล่าว ไมโครอัลบูมินจึงเป็นสารบ่งชี้ภาวะโรคไตที่สำคัญ [2] ในการพัฒนาไบโอเซนเซอร์สำหรับตรวจวัดไมโครอัลบูมินได้ประยุกต์ใช้ดีเอ็นเอแอพทาเมอร์ที่มีความจำเพาะเจาะจงกับไมโครอัลบูมิน [3] ดีเอ็นเอแอพทาเมอร์ คือดีเอ็นเอสายเดี่ยวที่สามารถขึ้นรูปเป็นโครงสร้างที่จับอย่างจําเพาะเจาะจงกับสารที่ต้องการตรวจวัดในลักษณะเดียวกับการจับระหว่างแอนติเจนและแอนติบอดี แต่ข้อดีของแอพทาเมอร์เหนือแอนติบอดีคือสามารถสังเคราะห์ได้ง่าย รวดเร็ว มีความเสถียร สามารถเก็บไว้ได้นาน และทนทานต่อสภาพแวดล้อม [4] โครงการวิจัยนี้ใช้ดีเอ็นเอแอพทาเมอร์เป็นส่วนจดจำทางชีวภาพ ร่วมกับวงจรดีเอ็นเอ (DNA circuits) ชนิด catalyzed hairpin assembly (CHA) [5] ซึ่งเป็นเทคนิคที่ช่วยเพิ่มความไววิเคราะห์ (sensitivity) ของเซนเซอร์โดยการสร้างดีเอ็นเอสายคู่ในปริมาณมากจากไมโครอัลบูมินปริมาณน้อยและเลือกใช้เทคนิค Förster Resonance Energy Transfer (FRET) ซึ่งเป็นเทคนิคเชิงแสงฟลูออเรสเซนซ์สำหรับรายงานการเกิดดีเอ็นเอสายคู่ดังกล่าว (รูปที่ 1)
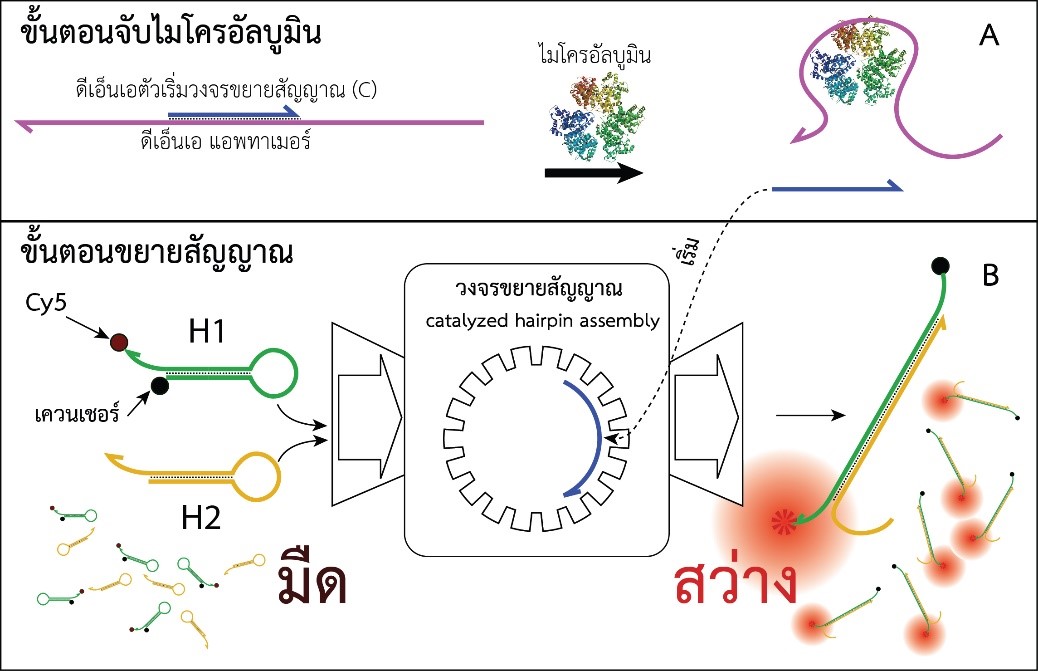
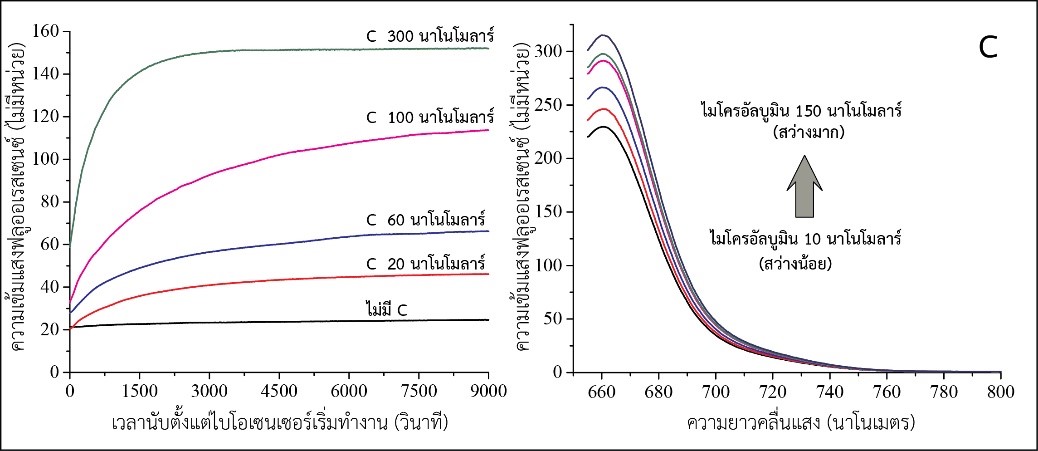
รูปที่ 1 (A) ขั้นตอนการทำงานของไบโอเซนเซอร์สำหรับตรวจวัดไมโครอัลบูมินโดยใช้ดีเอ็นเอแอพทาเมอร์ ร่วมกับ (B) วงจรขยายสัญญาณแบบ catalyzed hairpin assembly และ FRET โดยด้านซ้ายของ (C) แสดงการเพิ่มขึ้นตามเวลาของความเข้มแสงฟลูออเรสเซนซ์เมื่อวงจรขยายสัญญาณทำงานและ ด้านขวาแสดงการเพิ่มความเข้มแสงตามความเข้มข้นของไมโครอัลบูมิน
จากรูปที่ 1 การจับกันระหว่างไมโครอัลบูมินและดีเอ็นเอแอพทาเมอร์จะทำให้ดีเอ็นเอตัวเริ่มวงจรขยายสัญญาณ (C) หลุดเป็นอิสระเพื่อทำหน้าที่เป็นตัวเริ่มวงจรขยายสัญญาณทำให้เกิดการเปลี่ยนดีเอ็นเอสายเดี่ยว H1 และ H2 ให้เป็นดีเอ็นเอสายคู่ H1:H2 อย่างต่อเนื่องจน H1 และ H2 ในรูปสายเดี่ยวหมดไปจากสารละลาย ดังนั้นจะเห็นได้ว่าไมโครอัลบูมินปริมาณน้อยสามารถก่อให้เกิดดีเอ็นเอสายคู่ปริมาณมากซึ่งตรวจวัดได้ง่าย ผลการทดลองในรูปที่ 1C (ซ้าย) แสดงให้เห็นว่าความเข้มแสงฟลูออเรสเซนซ์เพิ่มขึ้นตามเวลาขณะที่วงจรขยายสัญญาณกำลังทำงานและเพิ่มขึ้นตามความเข้มข้นของดีเอ็นเอตัวเริ่มวงจรขยายสัญญาณ (C) จากผลการทดลองในรูปที่ 1C (ขวา) ยังแสดงให้เห็นว่าความเข้มแสงฟลูออเรสเซนซ์เพิ่มขึ้นตามความเข้มข้นของไมโครอัลบูมินตามสมมติฐานที่วางไว้
เคมิคัลเซนเซอร์สำหรับตรวจวัดไมโครอัลบูมินและครีเอทินิน
ครีเอทินิน (creatinine) เป็นสารที่พบได้ในเลือดของสัตว์เลี้ยงลูกด้วยนม เกิดจากกระบวนการย่อยครีเอทีน (creatine) ในกล้ามเนื้อ [6] ครีเอทินินถูกกำจัดออกจากร่างกายโดยการกรองที่ไต โดยค่าครีเอทีนินในปัสสาวะของคนปกติจะอยู่ระหว่าง 3.6 – 27.0 มิลลิโมลาร์ในผู้ชาย และ 3.3 – 22.5 มิลลิโมลาร์ในผู้หญิง [7] ซึ่งค่อนข้างคงที่ในช่วงนี้ในคนปกติ [8] แต่ค่าดังกล่าวจะเพิ่มสูงขึ้นในเลือดและลดน้อยลงในปัสสาวะของคนที่มีปัญหาเกี่ยวกับไต [9] ครีเอทินินจึงเป็นสารบ่งชี้โรคไตได้ดีอีกชนิดหนึ่ง การตรวจวัดครีเอทินินมีทั้งแบบตรวจวัดแยก และตรวจวัดพร้อมกันเป็นอัตราส่วนกับไมโครอัลบูมิน (albumin to creatinine ratio หรือ ACR) โครงการวิจัยนี้ได้พัฒนาเคมิคัลเซนเซอร์สำหรับตรวจวัดไมโครอัลบูมินและครีเอทินินพร้อมกันโดยอาศัยนาโนคลัสเตอร์ทองแดง ทั้งนี้เนื่องจากสังเคราะห์ได้ง่าย ให้สัญญาณความเข้มแสงฟลูออเรสเซนซ์ที่สูงจึงเหมาะกับการใช้เป็นตัวสร้างสัญญาณเพื่อบ่งบอกการจับระหว่างสารที่ต้องการตรวจวัดและเซนเซอร์ มีความเป็นพิษต่ำ [10] โดยใช้การเคลือบผิวนาโนคลัสเตอร์ทองแดงด้วยกลูตะไธโอน (glutathione (GSH)) เพื่อเพิ่มความเสถียรและสามารถทำอันตรกิริยากับไมโครอัลบูมินและครีเอทินินได้ในสภาวะที่เหมาะสม เกิดการเปลี่ยนแปลงสมบัติเชิงแสงของนาโนคลัสเตอร์ซึ่งเป็นสัดส่วนโดยตรงกับความเข้มข้นของไมโครอัลบูมินหรือครีเอทินิน ทำให้สามารถนำมาใช้เป็นเซนเซอร์ได้ ดังแสดงในรูปที่ 2A และ 2B
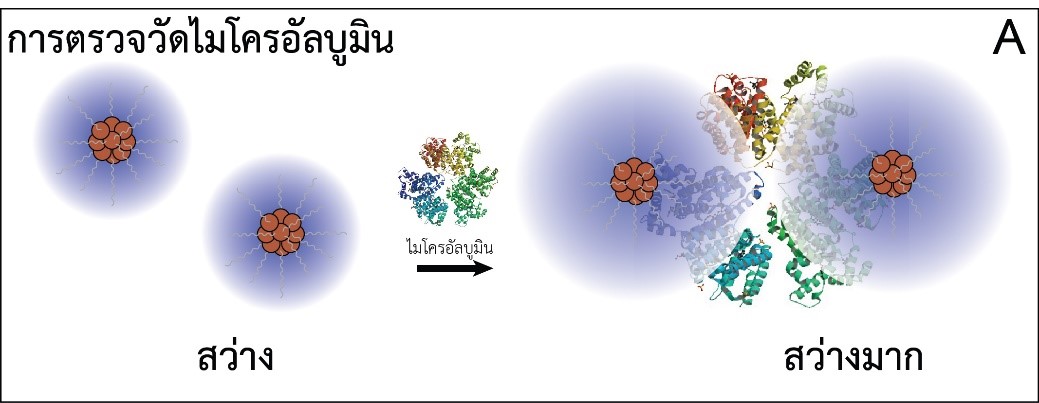
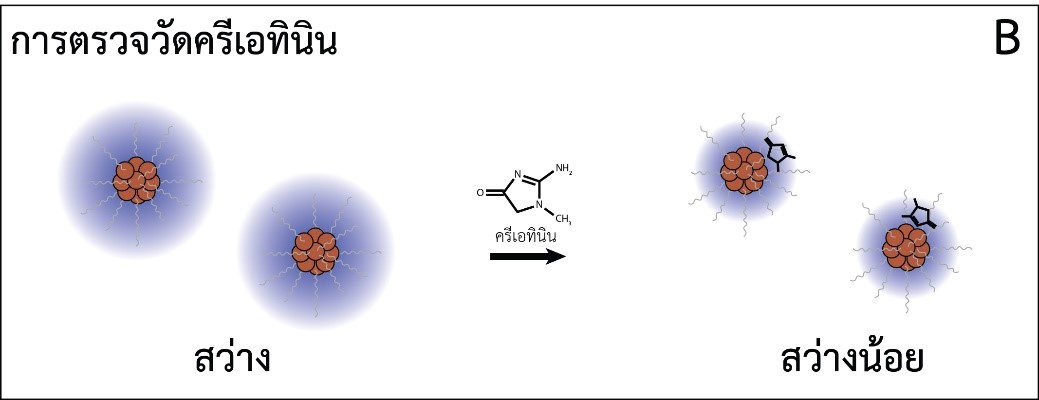
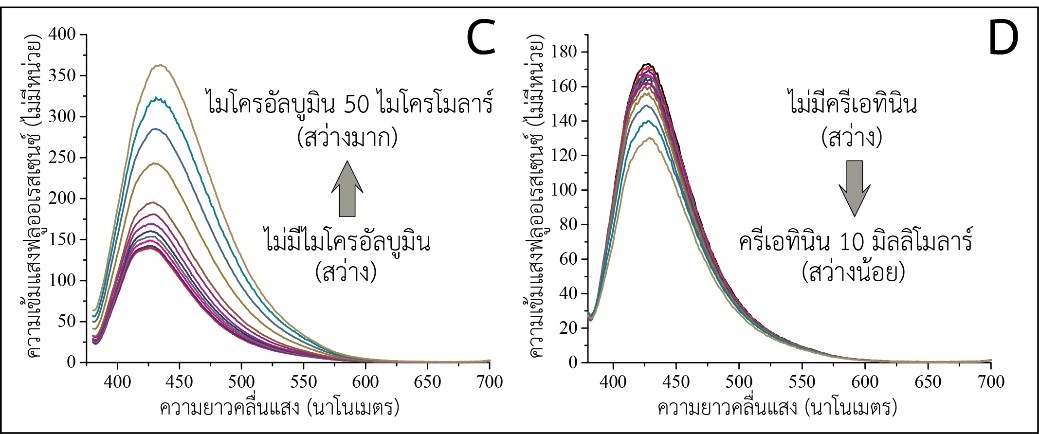
รูปที่ 2 การทำงานของเซนเซอร์เชิงแสงแบบใช้นาโนคลัสเตอร์ทองแดงสำหรับตรวจไมโครอัลบูมิน (A) และ ครีเอทินิน (B) ส่วน (C) และ (D) แสดงการเปลี่ยนแปลงของความเข้มแสงของนาโนคลัสเตอร์ทองแดงตามความเข้มข้นของไมโครอัลบูมิน และครีเอทินินตามลำดับ
ในสภาวะเบสพบว่าความเข้มแสงฟลูออเรสเซนซ์ของนาโนคลัสเตอร์ทองแดงสูงขึ้นตามความเข้มข้นของไมโครอัลบูมิน (รูปที่ 2C) ซึ่งคาดว่าเกิดจากไมโครอัลบูมินที่มีประจุลบในสภาวะเบสในขณะที่กลูตะไธโอนบนผิวนาโนคลัสเตอร์ทองแดงมีประจุบวกทำให้ไมโครอัลบูมินจับกับนาโนคลัสเตอร์ด้วยอันตรกิริยาทางไฟฟ้าและเกิดการรวมกลุ่มกัน และเมื่อนาโนคลัสเตอร์ทองแดงรวมกลุ่มกันความเข้มแสงฟลูออเรสเซนซ์จะเพิ่มสูงขึ้น [11] ส่วนในสภาวะกรดความเข้มแสงฟลูออเรสเซนซ์ลดลงตามความเข้มข้นของครีเอทินิน (รูปที่ 2D) ซึ่งคาดว่าเกิดจากการทำอันตรกิริยาระหว่างครีเอทินินกับอะตอมทองแดงบนผิวของนาโนคลัสเตอร์เกิดเป็นสารประกอบเชิงซ้อน [11] มีการถ่ายเทอิเล็กตรอนระหว่างครีเอทินินและนาโนคลัสเตอร์และส่งผลทำให้การเปล่งแสงฟลูออเรสเซนซ์ของนาโนคลัสเตอร์ลดลง
ไบโอเซนเซอร์สำหรับตรวจวัดโพแทสเซียมไอออน
โพแทสเซียมไอออน (potassium ion) มีความสำคัญในการทำงานของเซลล์ในร่างกายมนุษย์ ช่วยในการคงความสมดุลของของเหลวและอิเล็กโทรไลท์ภายในร่างกาย จากผลงานวิจัยก่อนหน้านี้พบว่าระดับโพแทสเซียมไอออนที่ผิดปกติอาจเป็นตัวบ่งชี้ถึงปัญหาสุขภาพ โดยเฉพาะโรคที่เกี่ยวกับความผิดปกติของไต เช่น primary renal diseases, glomerular nephritis, renal sclerosis และ renal failure [12-14]
มีการพัฒนาเทคนิคต่าง ๆ สำหรับการตรวจวัดโพแทสเซียมไอออน วิธีการหนึ่งที่นิยมใช้คือการใช้ไอออนซีเลคทีฟอิเล็กโทรด (Ion-selective electrode) ซึ่งเป็นอุปกรณ์ตรวจวัดทางเคมีไฟฟ้าที่จำเพาะเจาะจงกับโพแทสเซียมไอออน [15] อย่างไรก็ตามเพื่อเป็นการเปิดโอกาสให้เกิดการพัฒนาวิธีการและอุปกรณ์ตรวจวัดปริมาณ K+ ที่สามารถทำให้มีขนาดเล็ก มีราคาประหยัด และเหมาะสมกับการตรวจวัด ณ จุดดูแลผู้ป่วย (point of care) เพิ่มขึ้นอีกช่องทางหนึ่ง คณะผู้วิจัยจึงได้พัฒนาไบโอเซนเซอร์เชิงแสงที่ใช้งานง่ายสำหรับตรวจวัดปริมาณโพแทสเซียมไอออนโดยใช้ดีเอ็นเอ G-quadruplex (GQ) ซึ่งเป็นโครงสร้างตติยภูมิ (tertiary structure) ของดีเอ็นเอ มีลักษณะเป็นชั้นซ้อนกัน แต่ละชั้นประกอบด้วยกวานีน 4 โมเลกุลสร้างพันธะไฮโดรเจนระหว่างกัน เรียกว่า G quartet และมีไอออนบวก เช่น K+ แทรกอยู่ระหว่างชั้น ซึ่ง K+ จะช่วยลดแรงผลักระหว่างอะตอมออกซิเจนในเบสกวานีนทั้ง 8 ตัวที่อยู่ใกล้กัน (รูปที่ 3A) [16] จึงกล่าวได้ว่าความเสถียรของ GQ สัมพันธ์กับความเข้มข้นของ K+ และสามารถใช้ปริมาณของ GQ ในสารละลายซึ่งตรวจวัดได้ง่ายโดยอาศัยสารเรืองแสง Thioflavin T (ThT) ที่เปล่งแสงได้ดีขณะที่จับกับ GQ อย่างจำเพาะเจาะจง แต่ไม่เปล่งแสงในสภาวะอื่น [17] โดยมีสมมติฐานว่าความเข้มแสงของ ThT จะเพิ่มขึ้นตามความเข้มข้นของ GQ ซึ่งแปรผันตรงกับความเข้มข้นของ K+ ดังแสดงในรูปที่ 3A ซึ่งยืนยันด้วยผลการทดลองดังแสดงในรูปที่ 3B
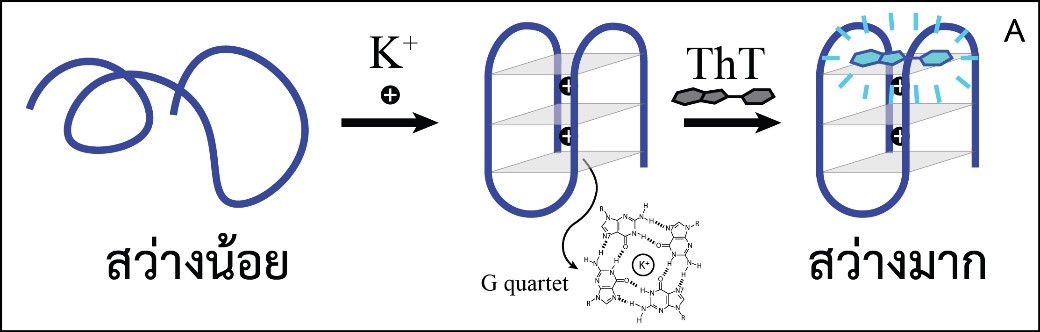
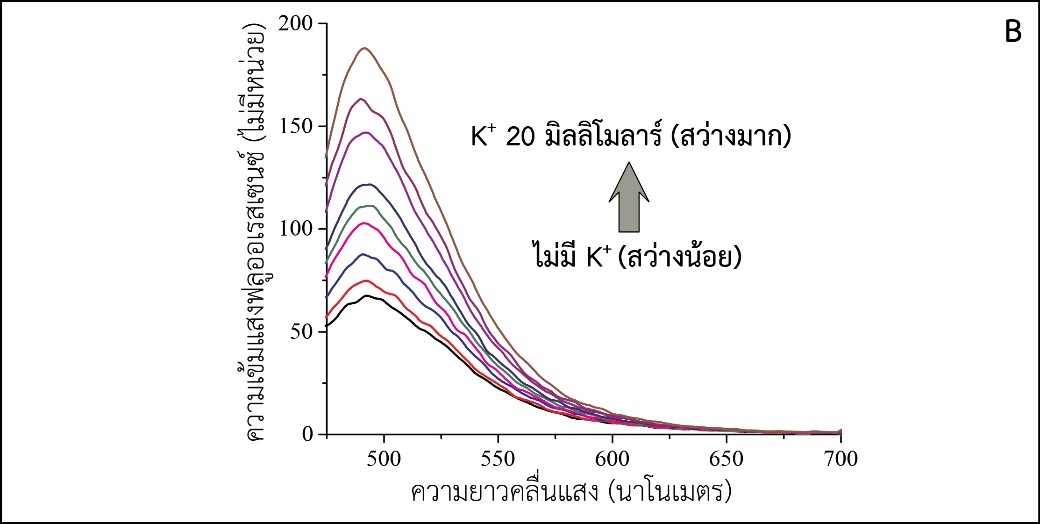
รูปที่ 3 (A) แสดงหลักการทำงานของไบโอเซนเซอร์สำหรับตรวจวัด K+ โดยอาศัยดีเอ็นเอ G-quadruplex และสารเรืองแสง Thioflavin T และ (B) ความเข้มแสงฟลูออเรสเซนซ์ของ ThT ที่เพิ่มขึ้นตามความเข้มข้นของ K+
การศึกษาอันตรกิริยาระหว่าง Thioflavin T และ ดีเอ็นเอ G-quadruplex ด้วยแบบจำลองทางคอมพิวเตอร์
เพื่อให้เกิดความเข้าใจการทำงานของเซนเซอร์สำหรับตรวจวัดโพแทสเซียมไอออนที่พัฒนาขึ้น ได้ศึกษาอันตรกิริยาระหว่าง Thioflavin T (ThT) และ ดีเอ็นเอ G-quadruplex (GQ) โดยใช้การจำลองทางคอมพิวเตอร์ระดับโมเลกุล ซึ่งพบว่ากระบวนการบิดของโครงสร้างของ ThT เมื่อถูกกระตุ้นด้วยแสง (กระบวนการโฟโตไอโซเมอร์ไรเซชัน) (รูปที่ 4) จะทำให้เกิดการเปล่งแสงฟลูออเรสเซนซ์ได้น้อยลง ทั้งนี้การจับกันระหว่าง ThT และ GQ มีทั้งแบบที่เกิดโฟโตไอโซเมอร์ไรเซชันได้ยากและง่ายดังแสดงในรูปที่ 5A แต่แบบที่เกิดไอโซเมอร์ไรเซชันได้ยาก (ทราบได้จากการคำนวณพลังงานอิสระของการเกิดโฟโตไอโซเมอร์ไรเซชัน ดังแสดงในรูปที่ 5B) จะมีความเสถียรในการจับกันมากกว่า ซึ่งสอดคล้องกับการทดลองที่พบว่าการจับกันของ ThT และ GQ จะทำให้เกิดการเปล่งแสงได้ดี
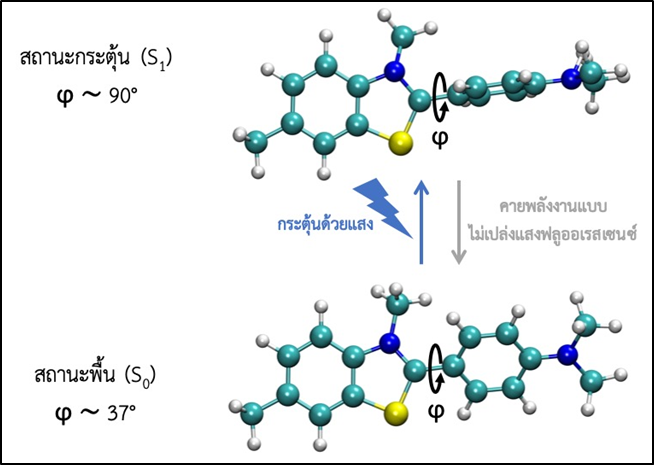
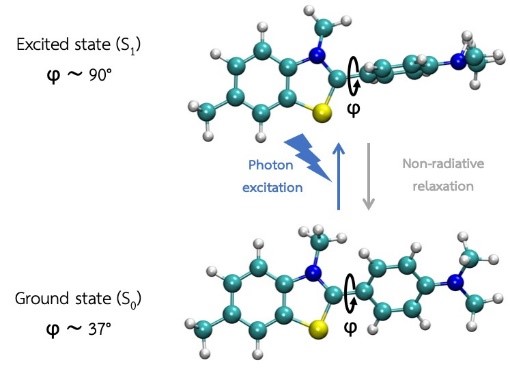
รูปที่ 4 กระบวนการโฟโตไอโซเมอร์ไรเซชันของ ThT โดยเกิดการบิดของโครงสร้างด้วยมุม ϕ ซึ่งเป็นผลมาจากการกระตุ้นโมเลกุลด้วยแสงจากสถานะพื้น ไปยังสถานะกระตุ้น
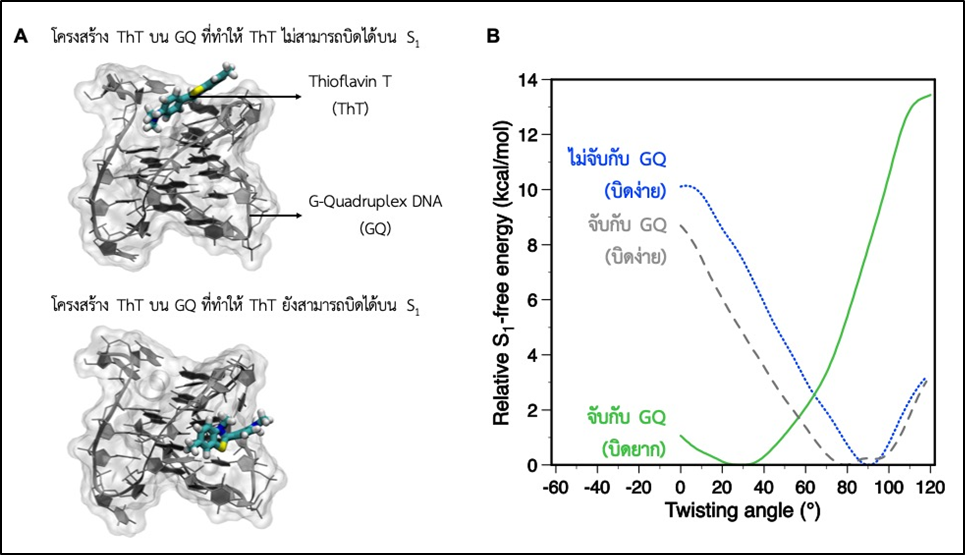
รูปที่ 5 (A) การจับกันระหว่าง ThT และ GQ แบบที่เกิดโฟโตไอโซเมอร์ไรเซชัน หรือการบิดของโครงสร้างได้ยากและง่าย (B)
พลังงานอิสระของการเกิดโฟโตไอโซเมอร์ไรเซชันของ ThT โดย ThT ที่ไม่ได้จับกับ GQ (สีฟ้า) และ ThT ที่จับกับ GQ แล้วเกิดการบิดง่าย (สีเทา) จะมีพลังงานต่ำที่มุมบิดประมาณ 90 องศา ส่วน ThT ที่จับกับ GQ แล้วเกิดการบิดยาก (สีเขียว) จะมีพลังงานต่ำที่มุมการบิดน้อยๆ เท่านั้น
คณาจารย์ผู้วิจัย
ผู้ช่วยศาสตราจารย์ ดร.ชิตนนท์ บูรณชัย ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
รองศาสตราจารย์ ดร.ปณต ถาวรังกูร ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
ผู้ช่วยศาสตราจารย์ ดร.ชุตินธร พันธ์วงศ์ ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
ดร.สุรีรัตน์ หอมหวล ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
ดร.ทัศนีย์วรรณ ลักษณะโสภิณ หลักสูตรวิศวกรรมชีวภาพ มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนบุรี
ผู้ช่วยศาสตราจารย์ ดร.จงดี บูรณชัย ภาควิชาเคมี คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
รองศาสตราจารย์ ดร.เพริศพิชญ์ คณาธารณา ภาควิชาเคมี คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
นักวิจัยระดับหลังปริญญาเอก
ดร.กิตติรัตน์ ภู่พลับ ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
นักศึกษา
นายวุฒินันท์ ทองยอด ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
นางสาวขวัญฤดี ชิดบ้านกล้วย ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
นางสาวสุพิชฌาย์ ธรรมจินโน ภาควิชาเคมี คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
นายอนุสรณ์ เนียมมูสิก ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์
เอกสารอ้างอิง
- Wang, R.E., L. Tian, and Y.-H. Chang, A homogeneous fluorescent sensor for human serum albumin. Journal of Pharmaceutical and Biomedical Analysis, 2012. 63: p. 165-169.
- Toto, R.D., Microalbuminuria: Definition, Detection, and Clinical Significance. The Journal of Clinical Hypertension, 2004. 6(s11): p. 2-7.
- Takenaka, M., et al., DNA-duplex linker for AFM-SELEX of DNA aptamer against human serum albumin. Bioorganic & Medicinal Chemistry Letters, 2017. 27(4): p. 954-957.
- Jayasena, S.D., Aptamers: An Emerging Class of Molecules That Rival Antibodies in Diagnostics. Clinical Chemistry, 1999. 45(9): p. 1628-1650.
- Yin, P., et al., Programming biomolecular self-assembly pathways. Nature, 2008. 451(7176): p. 318-322.
- Levey, A.S., R.D. Perrone, and N.E. Madias, Serum creatinine and renal function. Annual review of medicine, 1988. 39(1): p. 465-490.
- Ix, J.H., et al., Equations to Estimate Creatinine Excretion Rate: The CKD Epidemiology Collaboration. Clinical Journal of the American Society of Nephrology, 2011. 6(1): p. 184-191.
- Boeniger, M.F., L.K. Lowry, and J. Rosenberg, Interpretation of urine results used to assess chemical exposure with emphasis on creatinine adjustments: a review. American Industrial Hygiene Association journal, 1993. 54(10): p. 615-627.
- Songjaroen, T., et al., Portable microfluidic system for determination of urinary creatinine. Analytica Chimica Acta, 2009. 647(1): p. 78-83.
- Zheng, X.-J., et al., One-step, stabilizer-free and green synthesis of Cu nanoclusters as fluorescent probes for sensitive and selective detection of nitrite ions. Sensors and Actuators B: Chemical, 2016. 230: p. 314-319.
- Shahsavari, S., et al., Ligand functionalized copper nanoclusters for versatile applications in catalysis, sensing, bioimaging, and optoelectronics. Materials Chemistry Frontiers, 2019. 3(11): p. 2326-2356.
- Modesto, K.M., et al., Safety of Exercise Stress Testing in Patients With Abnormal Concentrations of Serum Potassium††Portions of this manuscript were published in abstract form in Circulation 2002;106(suppl):II-437 (used with permission). The American Journal of Cardiology, 2006. 97(8): p. 1247-1249.
- Yu, H.-R., et al., Portable Diagnosis Method of Hyperkalemia Using Potassium-Recognizable Poly(N-isopropylacrylamide-co-benzo-15-crown-5-acrylamide) Copolymers. Analytical Chemistry, 2013. 85(13): p. 6477-6484.
- Hong, Y.H., et al., Twenty-four Hour and Spot Urine Metabolic Evaluations: Correlations Versus Agreements. Urology, 2010. 75(6): p. 1294-1298.
- Yan, R., et al., Review of progresses on clinical applications of ion selective electrodes for electrolytic ion tests: from conventional ISEs to graphene-based ISEs. Chemical Speciation & Bioavailability, 2016. 28(1-4): p. 72-77.
- Forman, S.L., et al., Toward Artificial Ion Channels: A Lipophilic G-Quadruplex. Journal of the American Chemical Society, 2000. 122(17): p. 4060-4067.
- Amdursky, N., Y. Erez, and D. Huppert, Molecular Rotors: What Lies Behind the High Sensitivity of the Thioflavin-T Fluorescent Marker. Accounts of Chemical Research, 2012. 45(9): p. 1548-1557.
รายงานโดย
ผศ. ดร. ชิตนนท์ บูรณชัย ภาควิชาฟิสิกส์ คณะวิทยาศาสตร์ มหาวิทยาลัยสงขลานครินทร์ อ.หาดใหญ่ จ. สงขลา – 90110
E-mail: chittanon.buranachai@gmail.com