โรคโควิด-19 (COVID-19) เริ่มต้นขึ้นที่เมืองอู่ฮั่น เมืองเอกของมณฑลหูเป่ย์ สาธารณรัฐประชาชนจีน เมื่อเดือนธันวาคม พ.ศ. 2562 มาถึงวันนี้ (7 พฤษภาคม 2563) โรคนี้ได้ระบาดไปแล้ว 6 ใน 7 ทวีป (เหลือแต่เพียงทวีปแอนตาร์กติกา) มีผู้ติดเชื้อรวมกันทั่วโลก 3,822,860 คน และมีผู้เสียชีวิตจากไวรัสตัวนี้ไปแล้วรวม 265,076 คน [1] ถือเป็นการระบาดใหญ่ครั้งใหม่ต่อจากครั้งก่อนๆ เช่น
- โรค SARS ซึ่งเกิดขึ้นระหว่างเดือนพฤศจิกายน พ.ศ. 2545 – เดือนกรกฎาคม พ.ศ. 2546 โดยเริ่มต้นขึ้นที่เมืองฝอซาน มณฑลกวางตุ้ง สาธารณรัฐประชาชนจีน โรคนี้มีต้นเหตุเป็นไวรัสสายพันธุ์ SARS-CoV ซึ่งได้ระบาดไปยังประเทศต่างๆ 29 ประเทศ มีผู้ติดเชื้อรวมกันทั่วโลกประมาณ 8,000 คน และมีผู้เสียชีวิตจากไวรัสตัวนี้ 810 คน
- โรคไข้หวัดใหญ่ที่เรียกกันว่าไข้หวัดหมู (Swine flu) จากเชื้อไวรัส H1N1 สายพันธุ์ใหม่ ซึ่งเกิดขึ้นระหว่างเดือนมกราคม/มีนาคม พ.ศ. 2552 – สิงหาคม พ.ศ. 2553 โดยตั้งต้นจากรัฐเวราครูซ (Veracruz) ของประเทศเม็กซิโก คร่าชีวิตประชากรโลกไปประมาณ 203,000 คน
- ไข้หวัดใหญ่สปน (Spanish flu) ที่เกิดขึ้นระหว่างเดือนมกราคม พ.ศ. 2461 – ธันวาคม พ.ศ. 2463 ประเมินกันว่าคร่าชีวิตผู้คนไปประมาณ 39 ล้านคน (บางข้อมูลบอกว่าถึง 100 ล้านคน) โรคนี้เกิดจากเชื้อไวรัสสายพันธุ์ H1N1 เป็นต้น
สำหรับโรคโควิด-19 ซึ่งเชื้อโรคร้ายตัวต้นเหตุคือไวรัส SAR-CoV สายพันธุ์ใหม่ ที่เรียกว่าไวรัส SARS-CoV-2 นอกจากความสามารถในการแฝงเร้นกายโจมตีไม่ให้รู้เนื้อรู้ตัวที่หมายถึงคนติดเชื้อแต่ยังไม่แสดงอาการก็เป็น spreader ได้โดยตัวเองก็ไม่รู้ เมื่อผสมด้วยการเดินทางท่องเที่ยวโดยเครื่องบินที่รวดเร็วมากของโลกยุคปัจจุบันและการอาศัยอยู่อย่างหนาแน่นในเมืองใหญ่ จึงเสริมส่งกันให้การแพร่กระจายของโรคเป็นไปอย่างกว้างขวางในเวลาอันสั้น มีการประเมินว่าอัตราการแพร่กระจายของโรค Black Death (กาฬโรคที่เกิดจากการติดเชื้อแบคทีเรีย) ที่เกิดในยุโรปเป็นหลักเมื่อประมาณ 600 กว่าปีมาแล้ว คือ 1.5 กิโลเมตร/วัน ซึ่งก็ไม่แปลกเพราะพาหนะที่มีความเร็วสูงสุดในสมัยนั้นคือม้าและการเดินทางข้ามทวีปก็ใช้เรือใบ แต่เมื่อโลกเจริญขึ้นอัตราการแพร่กระจายของเชื้อโรคก็เร็วขึ้นตามไปด้วย เช่นกรณีของไวรัส Zika ที่เกิดการแพร่ระบาดเมื่อปีพ.ศ. 2558 ในอเมริกาใต้ อัตราการแพร่กระจายคือ 42 กิโลเมตร/วันโดยเฉลี่ย แต่ถ้าเฉพาะเจาะจงในเขตชุมชนแออัดของประเทศบราซิล อัตราการแพร่กระจายจะเพิ่มขึ้นเป็น 634 กิโลเมตร/วัน [2] มาถึงวันนี้ ภายในเวลาเพียงประมาณ 4-5 เดือนโรคโควิด-19 ได้แพร่ระบาดไปแล้วถึง 214 ประเทศและเขตปกครองตนเองทั่วโลก ดังนั้นถ้ายาหรือวัคซีนคือทางแก้ปัญหาเดียวสำหรับโรคระบาดใหญ่ระดับ pandemic ในสังคมโลกยุคปัจจุบันและอนาคต การคิดค้นยาและ/หรือวัคซีนจึงต้องทำแข่งกับเวลาอย่างยิ่ง
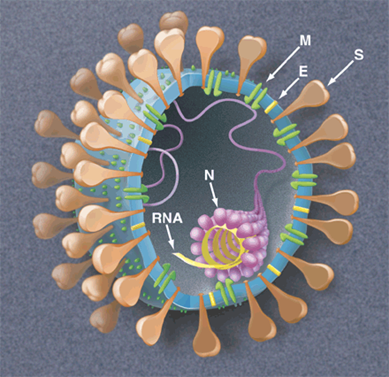
รูปที่ 1 ภาพวาดแสดงลักษณะทั้งภายนอกและภายในของไวรัส SARS-CoV-2 ที่มีลักษณะกลม ขนาดเส้นผ่านศูนย์กลางคือ 120-160 นาโนเมตร ส่วนเปลือกนั้นเป็นโปรตีน ซึ่งรวมถึงเดือย (spike) ที่โผล่ออกมาโดยรอบด้วย (จึงเรียกว่าโปรตีน S) ส่วนภายในจะมีแต่ RNA ที่มีลักษณะเป็นสายเดี่ยว (single strand) ซึ่งถูกหุ้มอยู่ด้วยโปรตีน N (ที่มาภาพ: https://science.sciencemag.org/content/300/5624/1377/F1)
ไวรัส SARS-CoV-2 (รูปที่ 1) จัดอยู่ในตระกูลโคโรนาไวรัส (coronavirus หรือ CoV) ที่รวมถึงไวรัสตัวต้นเหตุของโรค SARS และ MERS (หรือไข้หวัดอูฐ ที่เริ่มปรากฏโฉมเมื่อปีพ.ศ. 2555) เดือย S คือส่วนที่ไวรัสใช้ในการจับตัวกับเซลล์มนุษย์ (มีขนาดเฉลี่ยใหญ่กว่าไวรัสประมาณ 600 เท่า) โดยจะเข้าไปจับตัวกับโปรตีนตัวรับ ACE2 (angiotensin-converting enzyme 2) ตรงผิวของเซลล์มนุษย์ แล้วผลุบเข้าไปอยู่ภายในเซลล์ เปรียบเทียบได้ว่าเซลล์มนุษย์เป็นเหมือนบ้าน ACE2 เป็นเหมือนกับลูกบิดประตู ไวรัสนั้นเป็นขโมย เมื่อมือของโจร (เดือย S ไวรัส) ไปจับกับลูกบิดประตูได้แล้ว ก็เปิดโอกาสให้เข้าไปในบ้านได้ เมื่อเข้าไปแล้วจะใช้เอนไซม์ RNA พอลิเมอเรส (RNA polymerase) / เอนไซม์โปรตีเอส 3CL (3CL protease) ในกระบวนการจำลองตัวเอง (replication), การถอดรหัส (transcription) เพื่อสร้าง RNA แบบต้นฉบับเพิ่มขึ้น และการแบ่งตัวกับการเจริญเต็มที่ของโปรตีน เพื่อเกิดไวรัสตัวใหม่ หลุดออกมาจากเซลล์ตัวที่ถูกเบียน (host cell) แล้วไปโจมตีเซลล์อื่นๆต่อไป จากการศึกษาพบว่าเดือย S ของไวรัส SARS-CoV-2 มีความสามารถในการเข้าจับตัวกับเซลล์มนุษย์ได้ดีกว่าเดือย S ของไวรัส SARS ประมาณ 10-20 เท่า นี่อาจเป็นสาเหตุหนึ่งที่โรคโควิด-19 แพร่ติดต่อจากคนสู่คนได้ง่ายกว่าเมื่อครั้งของโรค SARS
แต่สิ่งที่นักปรุงยา/วัคซีนยุคใหม่จำเป็นต้องมีก็คือข้อมูลโครงสร้างที่ละเอียดที่สุดของไวรัส SARS-CoV-2 ซึ่งจะต้องอาศัยองค์ความรู้จากสายวิชาการที่เรียกว่า Structural Biology ที่หมายถึงการศึกษาโครงสร้างและการทำงานของมหโมเลกุลชีวภาพ (biological macromolecule) แขนงวิชานี้เข้ามามีบทบาทสำคัญในการคิดค้นตัวยาใหม่ๆตั้งแต่เมื่อประมาณ 30 ปีที่แล้ว นั่นคือการเปลี่ยนจากยุคที่ใช้วิธีลองผิดลองถูก (trial-and-error) มาเป็นยุคที่ใช้ข้อมูลประกอบอย่างมีหลักการ ปัจจุบัน Structural Biology จัดหาข้อมูลให้ได้รวดเร็วขึ้นมาก เพราะความก้าวหน้าของคอมพิวเตอร์ประมวลผล และเครื่องมือวิเคราะห์ ดังเช่นเมื่อประมาณ 30 ปีที่แล้ว ข้อมูลรายละเอียดโครงสร้างของมหโมเลกุลชีวภาพที่ส่งไปเก็บอยู่ใน Protein Data Bank (PDB) มีเพิ่มขึ้นประมาณ 2-3 โหล/ปี แต่ 5 ปีที่แล้ว มีเพิ่มขึ้นมากกว่า 500 ข้อมูล/ปี เครื่องมือวิเคราะห์ที่มีความจำเป็นต่อนัก Structural Biologist ก็ได้แก่เครื่องกำเนิดรังสีเอกซ์สมรรถนะสูง และกล้องจุลทรรศน์อิเล็กตรอนชนิดพิเศษ
เมื่อวันที่ 5 กุมภาพันธ์ พ.ศ. 2563 ที่ยังไม่ถึงหนึ่งเดือนด้วยซ้ำหลังทางการจีนประกาศถึงการอุบัติขึ้นของไวรัสโคโรน่าสายพันธุ์ใหม่นี้ นักวิทยาศาสตร์จีน 2 คนคือ ดร. Zihe Rao และ ดร. Haitao Yang แห่ง Shanghai Institute for Advanced Immunochemical Studies and School of Life Science and Technology ของ ShanghaiTech University ก็ได้อัพโหลดโครงสร้าง 3 มิติของโปรตีเอส 3CL ของไวรัส SARS-CoV-2 (รูปที่ 2) ลงใน Protein Data Bank (DOI: 10.2210/pdb6lu7/pdb) ศาสตราจารย์ Alexander Wlodawer นัก Structural Biologist (เรียนจบปริญญาเอกด้านชีวฟิสิกส์จาก University of California วิทยาเขต Los Angeles หรือ UCLA) หัวหน้าห้องปฏิบัติการวิจัย Macromolecular Crystallography Laboratory ของ ศูนย์วิจัยแห่งชาติ National Cancer Institute ของสหรัฐอเมริกา กล่าวว่า “ถ้าเป็นเมื่อ 10 ปีที่แล้ว ต้องใช้เวลาไม่ต่ำกว่า 1 ปี” เป็นการพูดจากประสบการณ์ที่ศาสตราจารย์ Wlodawer เคยมีส่วนร่วมในการพัฒนายาต้านไวรัส HIV ของโรค AIDS กล่าวคือเมื่อสามารถระบุได้ในปีพ.ศ. 2528 ว่าโปรตีเอสหลักของไวรัส HIV เป็นเอนไซม์ที่มีบทบาทสำคัญในกระบวนการเพิ่มจำนวนตัวเองเมื่อเข้าไปอยู่ในเซลล์ และเป็นจุดยุทธศาสตร์ที่จะใช้ยาเข้าโจมตีเพื่อยับยั้งการเพิ่มจำนวนของไวรัสตัวนี้ นักวิทยาศาสตร์ต้องใช้เวลาอีกถึง 4 ปีในการทดลองหาโครงสร้างของโปรตีเอสของไวรัส HIV และต้องใช้เวลาอีก 6 ปีถึงจะได้ยาต้านไวรัส HIV ที่ผ่านการรับรองของทางการตามมาตรฐานสากลออกมา (โรค AIDS ระบาดรุนแรงในหมู่ชาวเกย์ในสหรัฐอเมริกาเมื่อปีพ.ศ. 2524)
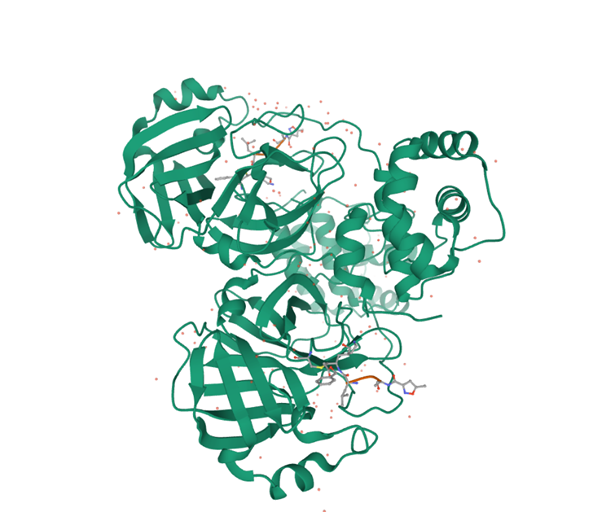
รูปที่ 2 ภาพ (3 มิติ) ความละเอียดสูงแรกสุดของโครงสร้างโมเลกุลโปรตีเอส 3CL ของไวรัส SARS-CoV-2 การได้รู้จักโครงสร้างของเอนไซม์โปรตีเอสนี้อย่างดีเป็นข้อมูลสำคัญในการคิดค้นยาเพื่อยับยั้งการเพิ่มจำนวนของไวรัสในร่างกายผู้ติดเชื้อ ยาต้านไวรัสที่มีขายอยู่ในท้องตลาดส่วนใหญ่ใช้หลักการนี้ ดังเช่นกรณีของโรค AIDS ก็มียาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์โปรตีเอสของไวรัส HIV แล้วหลายขนานที่ได้รับอนุมัติให้ใช้รักษาโรค AIDS ได้ (ที่มารูป: https://www.rcsb.org/structure/6LU7)
นักวิทยาศาสตร์จีนทั้งสองท่านและคณะสามารถทำได้รวดเร็วเช่นนั้นก็ด้วยการใช้เทคนิค X-ray Crystallography ที่รังสีเอกซ์ที่ใช้ในการส่องสำรวจโครงสร้างของโปรตีเอส 3CL (ที่อยู่ในรูปผลึก) เป็นชนิดพิเศษที่มีความเข้มสูงและมีช่วงความถี่ที่แคบมาก ต่างจากรังสีเอกซ์ที่ผลิตจากหลอดเอกซ์เรย์แบบดั้งเดิมมากมาย รังสีเอกซ์นี้ผลิตจากเครื่องเร่งอนุภาคขนาดใหญ่ที่ Shanghai Synchrotron Radiation Facility (SSRF) ที่นครเซี่ยงไฮ้ (รูปที่ 3)

รูปที่ 3 ภาพอาคารครอบเครื่องเร่งอนุภาคของศูนย์วิจัย SSRF ตัวเครื่องมีวงกักเก็บลำอิเล็กตรอนที่มีเส้นรอบวงยาว 432 เมตร สามารถเร่งให้อนุภาคอิเล็กตรอนมีพลังงานจลน์ได้สูงถึง 3.5 GeV (3.5 พันล้านอิเล็กตรอนโวลต์) เมื่ออิเล็กตรอนที่มีความเร็วสูงระดับเข้าใกล้ความเร็วแสงเช่นนี้วิ่งไปถึงมุมโค้ง จะถูกสนามแม่เหล็กภายนอกบังคับให้วิ่งโค้งตาม ขณะนั้นเองอนุภาคอิเล็กตรอนเกิดมีความเร่งเข้าสู่ศูนย์กลาง ตามหลักวิชาฟิสิกส์อนุภาคอิเล็กตรอนจะแผ่คลื่นแม่เหล็กไฟฟ้าที่เรียกกันว่า synchrotron radiation ออกมา SSRF เริ่มใช้งานได้เมื่อปีพ.ศ. 2552 มีมูลค่า 176 ล้านดอลลาร์สหรัฐ (ประมาณ 5.7 พันล้านบาท) การทดลองที่ทำให้ได้รูปที่ 2 ใช้ระบบลำเลียงแสง ณ สถานี 17U1 โดยใช้หัววัด EIGER X 16M [เครื่องของประเทศไทยอยู่ที่สถาบันวิจัยแสงซินโครตรอน (องค์การมหาชน) จ. นครราชสีมา ความยาวเส้นรอบวงของวงกักเก็บลำอิเล็กตรอนคือ 81.3 เมตร ให้พลังงานจลน์แก่อนุภาคอิเล็กตรอนได้ถึง 1.2 GeV] (ที่มารูป: https://www.youtube.com/watch?v=dyJJiTLnD7I)
การใช้รังสีเอกซ์เพื่อวิเคราะห์โครงสร้างของมหโมเลกุลชีวภาพด้วยเทคนิค X-ray Crystallography มีมาตั้งแต่เมื่อประมาณเจ็ดสิบปีที่แล้ว โดยศาสตราจารย์ Maurice Wilkins (รูปที่ 4) เป็นผู้ริเริ่มใช้รังสีเอกซ์ศึกษาโครงสร้างของ DNA ที่ Biophysics Unit ของภาควิชาฟิสิกส์แห่ง King’s College London สหราชอาณาจักร ซึ่งต่อมาเป็นข้อมูลสำคัญที่ช่วยให้ศาสตราจารย์ James Watson และศาสตราจารย์ Francis Crick (ขณะนั้นทั้งสองท่านทำงานอยู่ที่ภาควิชาฟิสิกส์ของมหาวิทยาลัยเคมบริดจ์) มองเห็นโครงสร้างเกลียวคู่ (double helix) ของ DNA เมื่อปีพ.ศ. 2496 ในสมัยนั้นรังสีเอกซ์เป็น “แสง” เพียงชนิดเดียวที่จะใช้ส่องสำรวจโครงสร้างของมหชีวโมเลกุลเช่นโปรตีนได้ เพราะรังสีเอกซ์มีความยาวคลื่น 1 อังสตรอม ซึ่งใกล้เคียงกับระยะห่างระหว่างอะตอมในโมเลกุลคือ 1-3 อังสตรอม และการทำให้อยู่ในรูปของผลึกก็เป็นการเพิ่มคุณภาพของการรวบรวมข้อมูลรูปแบบการหักเหของรังสีเอกซ์ เพราะวัดจากโมเลกุลที่เหมือนกันที่มีจำนวนมากระดับ 10-15 ตัว ไม่ใช่วัดจากมหโมเลกุลชีวภาพเพียงตัวเดียวซึ่งสัญญาณที่ได้จะอ่อนเกินไป


รูปที่ 4 (ซ้าย) ภาพถ่ายเมื่อประมาณปีพ.ศ. 2497 ของศาสตราจารย์ Maurice Wilkins (พ.ศ. 2459 – 2547) กับเครื่องกำเนิดรังสีเอกซ์ในยุคนั้น ท่านเป็นนักฟิสิกส์และนักชีวโมเลกุลชาวอังกฤษ เกิดที่ประเทศนิวซีแลนด์ เรียนจบปริญญาเอกสาขาฟิสิกส์จาก Birmingham University เมื่อปีพ.ศ. 2483 ได้รับรางวัลโนเบลสาขาสรีรวิทยาและการแพทย์ ประจำปีพ.ศ. 2505 ร่วมกับศาสตราจารย์ James Watson และศาสตราจารย์ Francis Crick จากผลงานการค้นพบโครงสร้างโมเลกุลของ DNA (ขวา) ร่วมกัน [1 อังสตรอม (Å) = 0.1 นาโนเมตร = 10-10 เมตร] (ที่มารูป: https://www.sciencehistory.org/historical-profile/james-watson-francis-crick-maurice-wilkins-and-rosalind-franklin และ https://www.toppr.com/ask/question/describe-watson-and-cricks-model-of-dna1/)
ในกรณีที่ไม่สามารถใช้เทคนิค X-ray Crystallography ดังกล่าวข้างต้นได้เพราะโมเลกุลชีวภาพหลายชนิดก็ไม่สามารถทำให้อยู่ในรูปของผลึกได้ หรือการทำให้เป็นผลึกจะทำให้โครงสร้างโมเลกุลเปลี่ยนไปจากเดิม ในปัจจุบันสามารถใช้วิธีถ่ายภาพโดยตรงได้แล้ว โดยใช้กล้องจุลทรรศน์อิเล็กตรอนชนิดพิเศษ เรียกว่า Cryogenic Electron Microscope หรือ Cryo-EM ซึ่งเป็นกล้องจุลทรรศน์อิเล็กตรอนแบบส่องผ่าน (transmission electron microscope) ที่ดัดแปลงต่อยอดให้เหมาะใช้กับสารตัวอย่างที่เป็นวัสดุชีวภาพ กล่าวคือวัสดุชีวภาพที่ต้องการส่องดูจะถูกแช่อยู่ในน้ำ แล้วเอาไปใส่ในแผ่นตะแกรงเพื่อจะได้สารตัวอย่างที่มีลักษณะเป็นชั้นบางๆ หลังจากนั้นจะถูกแช่เย็นอย่างรวดเร็วจนเป็นเหมือนแผ่นแก้วแข็งบางๆด้วยอีเทนเหลว (อุณหภูมิประมาณ -160 ถึง -180 เซลเซียส) การแข็งตัวจะต้องรวดเร็วมากพอที่น้ำจะไม่ก่อตัวเป็นผลึกซึ่งจะดูดกลืนลำอิเล็กตรอนทำให้ได้ภาพไม่ชัด นอกจากนั้นยังสามารถใช้ลำอนุภาคอิเล็กตรอนที่มีความเข้มต่ำลงเพื่อจะไม่ไปทำลายวัสดุชีวภาพก่อนที่จะได้ภาพที่สมบูรณ์ ผู้ที่บุกเบิกเทคนิคนี้ขึ้นมาเป็นนักชีวฟิสิกส์ 3 ท่านคือศาสตราจารย์ Jacques Dubochet แห่ง University of Lausanne ประเทศสวิตเซอร์แลนด์, ศาสตราจารย์ Joachim Frank แห่ง Columbia University ประเทศสหรัฐอเมริกา และศาสตราจารย์ Richard Henderson แห่ง MRC Laboratory of Molecular Biology สหราชอาณาจักร (รูปที่ 5) ที่ค่อยๆพัฒนาขึ้นตั้งแต่ประมาณปีพ.ศ. 2524 ผลงานนี้ทำให้ทั้งสามท่านได้รับรางวัลโนเบลสาขาเคมีประจำปีพ.ศ. 2560

รูปที่ 5 (ซ้าย) ศาสตราจารย์ Richard Henderson เป็นชาวสก๊อตโดยกำเนิด ปัจจุบันอายุ 74 ปี เรียนจบปริญญาตรีสาขาฟิสิกส์จาก University of Edinburg และปริญญาเอกสาขาชีวฟิสิกส์จากมหาวิทยาลัยเคมบริดจ์เมื่อปีพ.ศ. 2513, (กลาง) ศาสตราจารย์ Joachim Frank เป็นชาวเยอรมันโดยกำเนิด แต่ถือสัญชาติอเมริกัน ปัจจุบันอายุ 79 ปี เรียนจบปริญญาตรีสาขาฟิสิกส์จาก University of Freiburg และปริญญาเอกสาขาฟิสิกส์จาก Technical University of Munich เมื่อปีพ.ศ. 2513 และ (ขวา) ศาสตราจารย์ Jacques Dubochet เป็นชาวสวิสโดยกำเนิด ปัจจุบันอายุ 77 ปี เรียนจบปริญญาตรีสาขาฟิสิกส์จาก École Polytechnique Fédérale de Lausanne และปริญญาเอกสาขาชีวฟิสิกส์จาก University of Geneva และ University of Basel เมื่อปีพ.ศ. 2516 (ที่มารูป: https://indianexpress.com/article/explained/nobel-prize-in-chemistry-2017-jacques-dubochet-joachim-frank-richard-henderson-molecules-of-life-captured-in-3d-4874713/)
Cryo-EM ได้รับการพัฒนามาอย่างต่อเนื่อง ปัจจุบันได้กลายเป็นเครื่องมือที่มีประโยชน์มากในการใช้ส่องดูและศึกษาโครงสร้างของโมเลกุลชีวภาพต่างๆ มีประโยชน์ต่อการค้นคว้าวิจัยเพื่อการเข้าใจโรค AIDS (ปัจจุบันไวรัส HIV ก็ยั้งคงแผลงฤทธิ์อยู่ คร่าชีวิตผู้คนทั่วโลกไปแล้วไม่ต่ำกว่า 32 ล้านคน), โรคมะเร็ง, โรคพาร์กินสัน, โรคฮันติงตัน, โรคอัลไซเมอร์ และโรคมาเลเรีย เป็นต้น รูปที่ 6 เป็นตัวอย่างรูปร่างหน้าตาของเครื่อง Cryo-EM โดยทั่วไปมีอำนาจการจำแนกระดับ 3.8 อังสตรอมหรือดีกว่า Cryo-EM รุ่นท็อปอาจมีราคาถึง 7 ล้านดอลลาร์สหรัฐ (ประมาณ 227 ล้านบาท) และค่าดำเนินการอาจสูงได้ถึงวันละ 10,000 ดอลลาร์สหรัฐ (ประมาณ 3.2 แสนบาท)

รูปที่ 6 เครื่อง Cryo-EM ที่ CryoElectron Microscopy Lab ของ Nanyang Technological University ประเทศสิงคโปร์ (ที่มารูป: http://nisb.ntu.edu.sg/Research/facilities/Pages/Cryo-EM-Lab.aspx)
รูปที่ 7 คือภาพโครงสร้างโมเลกุลของเดือย S ของไวรัส SARS-CoV-2 ที่ถ่ายด้วยกล้อง Cryo-EM ที่ห้องปฏิบัติการวิจัยของศาสตราจารย์ Jason McLellan แห่ง University of Texas วิทยาเขตเมือง Austin โดยหลังบันทึกภาพ 2 มิติในมุมต่างๆเสร็จ ทีมงานต้องใช้เวลาถึง 12 วันในการประมวลผลภาพ 2 มิติเหล่านั้นให้เป็นภาพ 3 มิติของโครงสร้างโมเลกุล ซึ่งได้รับการเผยแพร่ในวารสาร Science อันมีชื่อเสียงเมื่อวันที่ 19 กุมภาพันธ์ พ.ศ. 2563 การได้รู้ว่าไวรัสทะลวงเข้าไปในเซลล์มนุษย์ได้อย่างไรเป็นข้อมูลที่มีค่าสำหรับการคิดค้นยาหรือวัคซีนที่จะเข้าไปบล็อค (block) เดือย S ของไวรัสหรือตัวรับ ACE2 ของเซลล์มนุษย์ ปิดโอกาสที่ไวรัสจะเข้าไปข้างในเซลล์ ถึงแม้ยาที่ใช้หลักการนี้จะยังไม่เคยมีการนำมาใช้จริง แต่สามารถใช้ประสบการณ์จากการคิดค้นวัคซีนสำหรับโรค SARS และ MERS ได้ เพราะทำสำเร็จแล้วในห้องทดลอง เพียงแต่ไม่เคยถูกผลิตออกสู่ตลาด
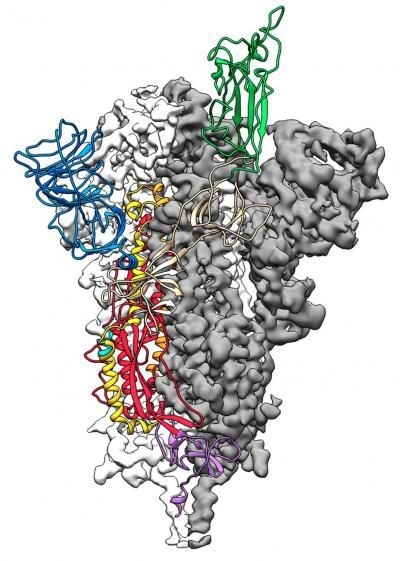
รูปที่ 7 ภาพแรกสุดของโครงสร้างโมเลกุลของเดือย S ของไวรัส SARS-CoV-2 ส่วนที่เข้าจับตัวกับตัวรับ ACE2 คือส่วนที่ระบายด้วยสีเขียว (ที่มารูป: https://www.livescience.com/coronavirus-spike-protein-structure.html)
ผู้เชี่ยวชาญอย่างเช่นศาสตราจารย์ Jason McLellan คาดการณ์ว่ากว่าจะได้ยาหรือวัคซีนออกมาต้องใช้เวลาประมาณ 18 ถึง 24 เดือน (แต่ผู้เชี่ยวชาญจาก U.S. Centers for Disease Control and Prevention คาดว่าต้องใช้เวลาประมาณ 1-1.5 ปี) เพราะโดยปกติเมื่อประสบความสำเร็จในการทดลองกับสัตว์เช่นหนูทดลองแล้ว ต้องขออนุญาตจากทางการ (เช่นองค์การอาหารและยาแห่งสหรัฐอเมริกา หรือ FDA ในกรณีของสหรัฐอเมริกา) เพื่อขอทดลองกับคน ซึ่งต้องใช้เวลาในขั้นตอนนี้ไม่ต่ำกว่า 2-3 เดือน และเมื่อนำไปทำการทดลองกับคนก็ต้องใช้เวลาอีกไม่ต่ำกว่า 1 ปี เพราะไม่ใช่สนใจแต่ผลสัมฤทธิ์ของยา/วัคซีนต่อการยับยั้งไวรัส แต่ต้องคำนึงถึงความปลอดภัยของผู้ใช้หรือผลข้างเคียงด้วย ยกตัวอย่างเช่นกรณีของยา Xofluza ที่ค้นพบโดย Shionogi บริษัทวิจัยและผลิตยาเจ้าสำคัญของประเทศญี่ปุ่น สำหรับรักษาโรคไข้หวัดใหญ่ที่เกิดจากไวรัสหลายสายพันธุ์เช่น H1N1, H3N2, H5N1 และ H7N9 ในปีพ.ศ. 2561 เมื่อบริษัท Shionogi ร่วมมือกับห้องปฏิบัติการวิจัย European Molecular Biology Laboratory (EMBL) สาขาเมือง Grenoble ประเทศฝรั่งเศส ศึกษากลไกการทำงานของยาให้ลึกซึ้งขึ้น ได้พบจากสารคัดหลั่งในโพรงจมูกและลำคอของผู้ที่ใช้ยา Xofluza ไปได้ระยะหนึ่งว่าเกิดมีการกลายพันธุ์ของไวรัส เอนไซม์พอลิเมอเรสที่กลายพันธุ์จะไม่ค่อยจับตัวกับยา ส่งผลให้ไวรัสดื้อต่อยา Xofluza แต่เอนไซม์พอลิเมอเรสนี้ก็มีประสิทธิภาพในการกระตุ้นการจำลองตัวเองของไวรัสกลายพันธุ์ลดลงด้วย [3] ต่อมามีข่าวว่าเด็กชายอายุ 11 ปีชาวญี่ปุ่นคนหนึ่ง ที่ป่วยเป็นไข้หวัดใหญ่จากไวรัสสายพันธุ์ H3N2 หลังจากใช้ยา Xofluza ไปได้ 2-3 วัน ก็เกิดไม่ตอบสนองต่อยา และต่อมาน้องสาวก็เกิดป่วยอีกคน เมื่อตรวจอย่างละเอียดก็พบว่าไวรัสในตัวเธอเป็นสายพันธุ์ H3N2 ที่กลายพันธุ์ ซึ่งอาจเป็นสาเหตุที่อาการป่วยของเธอดื้อต่อยา Xofluza จากการตรวจสอบโดยศาสตราจารย์ Yoshihiro Kawoka แห่ง University of Wisconsin สหรัฐอเมริกา ได้พบว่าการกลายพันธุ์ของไวรัสดังกล่าวมักจะเกิดในเด็กมากกว่าผู้ใหญ่ [4] ดังนั้นบริษัท Shionogi และพันธมิตรคือบริษัท Roche และ Genentech จึงต้องค้นคว้าวิจัยเพิ่มเติมเพื่อแก้ปัญหาดังกล่าวของยา
รูปที่ 8 กลไกการทำงานของยา Xofluza ก็คือจะไปยับยั้งการทำงานของเอนไซม์พอลิเมอเรสของไวรัส ทำให้ไม่เกิดการจำลองตัวเองที่เป็นวิธีเพิ่มจำนวนของไวรัสในร่างกายผู้ติดเชื้อ การเจ็บไข้ได้ป่วยจึงถูกยับยั้งไปด้วย ยา Xofluza ได้รับอนุมัติให้ใช้ในทางการแพทย์ได้ในประเทศญี่ปุ่นและสหรัฐอเมริกาเมื่อปีพ.ศ. 2561
ประวัติศาสตร์ได้บอกไว้ชัดแล้วว่าสังคมมนุษย์ไม่เคยหายขาดจากโรคระบาดใหญ่ ไวรัสในป่าที่เรายังไม่รู้จักยังมีอยู่อีกมากมาย เราได้เห็นตัวอย่างแล้วว่าโควิด-19 อาละวาดสร้างความปั่นป่วนและเสียหายให้แก่สังคมและเศรษฐกิจอย่างไร แต่การป้องกันการระบาดครั้งต่อไปเป็นเรื่องยาก เพราะไม่อาจรู้ล่วงหน้าว่าจะเกิดขึ้นเมื่อใดและเป็นไวรัสสายพันธุ์ใด ไวรัสนั้นกลายพันธุ์ไปได้เรื่อย ศาสตราจารย์ Stephen A. Cusack หัวหน้าห้องปฏิบัติการวิจัย EMBL ที่ Grenoble (เรียนจบปริญญาเอกสาขาฟิสิกส์จาก Imperial College London เมื่อปีพ.ศ. 2519) เคยกล่าวว่า “The virus is always clever than you are.” ทางแก้ปัญหาจึงอยู่ที่ต้องมีกระบวนการผลิตยาหรือวัคซีนออกมาให้ได้เร็วที่สุด นั่นคือวิทยาศาสตร์ของเรื่องนี้จะต้องได้รับการสนับสนุนและส่งเสริมให้เกิดการร่วมมือกันในระดับนานาชาติอย่างเข้มแข็ง ต้องไม่หยุดยั้งในการพัฒนาเครื่องมือส่องสำรวจและวิเคราะห์โครงสร้างของโมเลกุลชีวภาพที่ดียิ่งขึ้น เช่นเครื่องเร่งอนุภาคซินโครตรอนที่ว่าดีกว่าเครื่องกำเนิดรังสีเอกซ์แบบหลอดดังกล่าวแล้วข้างต้น แต่ว่ากันว่ายังมีดีกว่านั้นอีกคือเครื่อง Free Electron Laser (FEL) เพราะสามารถผลิตรังสีเอกซ์แบบ X-FEL (รูปที่ 9) ที่มีความเข้มสูงกว่ารังสีเอกซ์จากเครื่องเร่งอนุภาคซินโครตรอนถึงพันล้านเท่า ซึ่งจะเพิ่มประสิทธิภาพของการวัดหาโครงสร้างของโมเลกุลชีวภาพขึ้นอย่างมากมาย และการพัฒนาระบบเครื่องคอมพิวเตอร์สมรรถนะสูงสำหรับการประมวลผลเพื่อสร้างภาพ 3 มิติได้อย่างรวดเร็วยิ่งขึ้น จะต้องมีบุคลากรและหน่วยงานรับผิดชอบที่คิดค้นหาหนทางในการพัฒนาและผลิตยา/วัคซีนที่ใช้เวลาน้อยกว่าปัจจุบันมาก ไม่ใช่ต้องรอกันเป็นปี ไวรัสตัวใหม่ของการระบาดใหญ่ครั้งหน้าอาจร้ายกาจรุนแรงยิ่งกว่าเจ้า SARS-CoV-2 นี้ก็เป็นได้
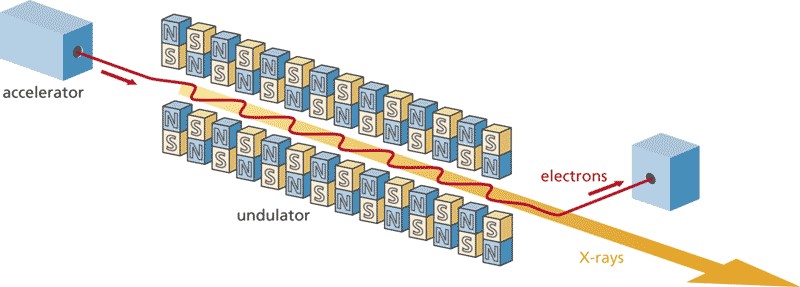
รูปที่ 9 แผนภาพแสดงหลักการพื้นฐานของการผลิตรังสีเอกซ์แบบ X-FEL เริ่มต้นจากเครื่องเร่งอนุภาค (accelerator) ผลิตอนุภาคอิเล็กตรอน (แนวเส้นสีแดง) ที่มีความเร็วเข้าใกล้ความเร็วของแสง และมีลักษณะเป็นห้วงที่ห่างกันน้อยกว่า 20 เฟมโตวินาที (20×10-15 วินาที) ซึ่งจะถูกส่งเข้าสู่แถวแม่เหล็กสลับขั้วที่เรียกกันว่า “undulator” กลุ่มอนุภาคอิเล็กตรอนที่มีความเร็วสูงมากเมื่อต้องวิ่งโค้งไปโค้งมาเพราะถูกบังคับด้วยสนามแม่เหล็กที่สลับทิศขึ้นลงอย่างเป็นระเบียบของ undulator จะปลดปล่อยรังสีเอกซ์ออกมาในทิศที่พุ่งไปด้านหน้า ด้วยการออกแบบทุกองค์ประกอบอย่างเหมาะเหม็ง รังสีเอกซ์จะถูกปลดปล่อยออกมาอย่างเข้าจังหวะกัน แต่ด้วยรังสีเอกซ์มีความเร็วสูงกว่าอนุภาคอิเล็กตรอนเสมอ รังสีเอกซ์ที่ออกมาจาก undulator จึงเสริมกันทำให้มีความเข้มสูงมาก [ในแง่นี้คล้ายกับหลักการเกิดแสงเลเซอร์ เพียงแต่ในกรณีของแสงเลเซอร์นั้นเกิดจากการลดระดับพลังงานของอิเล็กตรอนในอะตอมโครเมี่ยม (ในกรณีของเลเซอร์ทับทิม) คือไม่ได้เป็นอิเล็กตรอนอิสระเหมือนกรณี FEL] ด้วยพลังงานจลน์ของอิเล็กตรอนระดับ 8 GeV รังสีเอกซ์ที่ผลิตได้จะครอบคลุมช่วงปลายของ soft x-rays ถึงช่วงต้นของ hard x-rays (ในตอนท้ายอนุภาคอิเล็กตรอนจะถูกแม่เหล็กตรงปลาย undulator บังคับให้เลี้ยวออกจากแนวตรงเพื่อเอาไปทิ้ง) (ที่มารูป: https://www.psi.ch/en/swissfel/how-it-works)
เอกสารอ้างอิง
- “COVID-19 CORONAVIRUS PANDEMIC”, worldometer, ที่เว็บไซต์: https://www.worldometers.info/coronavirus/
- Jon Cartwright, “COVID-19: how physics is helping the fight against the pandemic”, Physicsworld, 19 March 2020, ที่เว็บไซต์: https://physRicsworld.com/a/covid-19-how-physics-is-helping-the-fight-against-the-pandemic/
- “Flu’s response to new drug explored”, ScienceDaily, 26 June 2018, ที่เว็บไซต์: https://www.sciencedaily.com/releases/2018/06/180626113344.htm
- Arlene Weintraub, “Roche’s flu med Xofluza drives drug resistance and may be a bad choice for kids, study says”, FiercePharma, 26 November 2019, ที่เว็บไซต์: https://www.fiercepharma.com/pharma/roche-s-flu-med-xofluza-drives-drug-resistance-and-may-be-a-bad-choice-for-kids-study-says